高級氧化技術的定義:利用強氧化性的自由基來降解有機污染物的技術,泛指反應過程有大量羥基自由基參與的化學氧化技術。其基礎在于運用催化劑、輻射,有時還與氧化劑結合,在反應中產生活性極強的自由基(一般為羥基自由基,· OH),再通過自由基與污染物之間的加合、取代、電子轉移等使污染物全部或接近全部礦質化。· OH反應是高級氧化反應的根本特點。
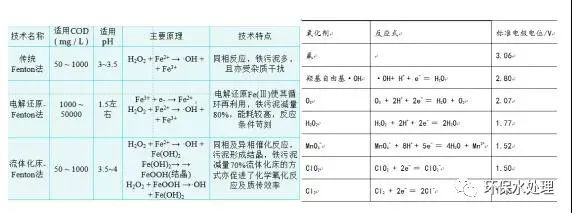
2. 高級氧化方法及其作用機理是通過不同途徑產生· OH自由基的過程。· OH自由基一旦形成,會誘發一系列的自由基鏈反應,攻擊水體中的各種有機污染物,直至降解為二氧化碳、水和其它礦物鹽。可以說高級氧化技術是以產生· OH自由基為標志。3. 高級氧化技術有什么特點?①反應過程中產生大量氫氧自由基· OH;②反應速度快;③適用范圍廣,· OH幾乎可將所有有機物氧化直至礦化,不會產生二次污染;④可誘發鏈反應;⑤可作為生物處理過程的預處理手段,使難以通過生物降解的有機物可生化性提高,從而有利于生物法的進一步降解;⑥操作簡單,易于控制和管理。4.· OH自由基的優點①選擇性小,反應速度快;②氧化能力強;③處理效率高;④氧化徹底。5.高級氧化技術分為哪幾類?①化學氧化法:臭氧氧化/Fenton氧化/高鐵氧化②電化學氧化法③濕式氧化法:濕式空氣氧化法/濕式空氣催化氧化法④超臨界水氧化法⑤光催化氧化法⑥超聲波氧化法⑦過硫酸鹽氧化法6.自由基與污染物反應的四種主要方式:氫抽提反應、加成反應、電子轉移、(氧化分解)。自由基反應的三個階段:鏈的引發、鏈的傳遞、鏈的終止自由基反應具有無選擇性,反應迅速的特點。7.產生羥基自由基的途徑:Fe2+/H2O2 、 UV/H2O2 、 H2O2/O3 、 UV/O3 、 UV/H2O2/O3 、光催化氧化(TiO2光催化氧化反應機理:產生空穴和電子對),對有機物降解速率由快到慢依次為UV-Fenton、 Fenton、 O3/US、O3、O3/UV、UV/H2O2、UV。8.Fenton試劑:亞鐵離子(Fe2+)和過氧化氫(H2O2)的組合。Fenton反應:Fenton反應是以亞鐵離子作為催化劑來催化過氧化氫(H2O2),使其產生羥基自由基(·OH),進行有機物的氧化,羥基自由基具有強的氧化能力,可與大部分的芳香族有機物進行反應,同時亞鐵離子氧化成鐵離子(Fe3+),(鐵離子有混凝作用也可去除部分有機物)鐵離子又會與雙氧水反應,并還原成亞鐵離子(Fe2+).反應機理:H2O2與Fe2+反應分解生成羥基自由基(·OH)和氫氧根離子(OH-),并引發連鎖反應從而產生更多的其它自由基,然后利用這些自由基進攻有機質分子,從而破壞有機質分子并使其礦化直至轉化為CO2、H2O等無機質(Fenton試劑在廢水處理中主要用于去除COD、色度和泡沫等)。Fe2++ H2O2→ · OH + OH-+ Fe3+Fe3++ H2O2→ Fe2++ ·HO2+ H+9.影響Fenton試劑氧化能力的因素:①催化劑種類及投加方式,Fe2+(Fe3+、鐵粉、鐵屑)、 Fe2+/TiO2/Cu2+/Mn2+/Ag+、活性炭等均有一定的催化能力,FeS04·7H20最常用。②過氧化氫濃度及投加方式,均勻分批投加。③反應溫度(芬頓試劑的反應速率隨溫度上升而增加,但是溫度高于40℃~50℃之后,會加速分解為O2和H2O,因此多控制在20℃~40℃中發生)。④溶液的pH值, pH 2-4為Fenton反應的最佳范圍。⑤反應時間。10.類Fenton試劑:改性-Fenton試劑、光-Fenton試劑、電-Fenton試劑、配體-Fenton試劑等。Fe(Ⅲ)鹽溶液、可溶性鐵以及鐵的氧化礦物(如赤鐵礦、針鐵礦等)同樣可使H2O2催化分解產生·OH,達到降解有機物的目的,以這類催化劑組成的Fenton試劑,稱為類Fenton試劑(改性Fenton試劑,因其鐵的來源較為廣泛)。由于Fenton法處理廢水所需時間長,使用的試劑量多,而且過量的Fe2+將增大處理后廢水中的COD并產生二次污染。近年來,人們將紫外光、可見光等引入Fenton體系并研究采用其它過渡金屬替代Fe2+,這些方法可顯著增Fenton試劑對有機物的氧化降解能力,并可減少Fenton試劑的用量,降低處理成本被統稱為類Fenton反應。11.增強fenton反應活性的方法:①加入草酸鹽和檸檬酸;②與其他處理方法聯用,如生物法、混凝法;③加入絡合劑,如EDTA等;④Mn2+、Co3+。(混凝沉降法、活性炭法、生物法、UV)Fenton試劑在廢水處理中的應用:處理染料廢水;處理含氯酚廢水;處理垃圾填埋滲濾液;處理制藥廢水。12.氧化電位
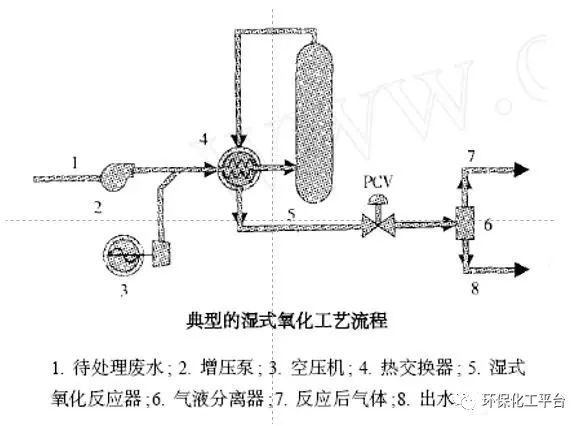
13.臭氧氧化的定義:臭氧具有極強的氧化性能,臭氧分子中的氧原子具有強烈的親電子或親質子性,臭氧分解會產生的新生態氧原子和在水中形成具有強氧化作用的羥基自由基·OH來氧化分解水中的污染物。14.臭氧與有機物的反應途徑(或機理)◆直接反應:污染物+ O3→產物或中間物(有選擇性,速度慢);◆間接反應:污染物+ HO·→產物或中間物(無選擇性,HO·(E0=2.8V)電位高,反應能力強,速度快,可引發鏈反應,使許多有機物徹底降解)15.臭氧氧化性能的影響因素:臭氧化混合氣進氣量、攪拌速度溶液pH、有機物濃度、溶液溫度、催化劑、投加方式16.增強臭氧氧化的措施方法:①改變臭氧化混合氣的進氣量,就是改變單位時間內的臭氧投加量,在有機負荷一定的條件下,就是改變反應過程中臭氧和有機物的投加比,在有機物濃度一定、連續地通入臭氧化混合氣的半連續半間歇操作中,隨單位時間內臭氧通入量的增加,有機物氧化反應速率相應提高。②超聲強化臭氧氧化技術。③金屬催化臭氧化技術、在臭氧水處理體系中,加入一定量的Fe2+、Mn2+、Co2+、Ni2+或Co2+的硫酸鹽。④臭氧與其他常規水處理單元結合比如O3-活性污泥、O3-活性炭吸附、O3-絮凝-膜處理、O3-絮凝-O3、O3-氣浮(吹脫)、O3-生物活性炭、O3-膜處理。幾種臭氧處理單元自身的改進:(1) O3/U V高級氧化技術(2) O3/H2O2高級氧化技術(3) O3/H2O2/UV(4)臭氧/活性炭協同降解有機物處理技術(5)超聲強化臭氧氧化技術17.臭氧在水處理中的應用——飲用水處理/廢水處理/去除染料和印染廢水的色度和難降解有機物/處理含金屬離子廢水/循環冷卻水的處理。在飲用水處理中,臭氧主要用于三個方面:1)臭氧預處理,在常規凈水工藝前增設臭氧工藝;2)臭氧-生物活性炭處理,O3與顆粒活性炭結合,在常規凈水工藝后,對水作深度處理,以除去各種有機物和色、嗅、味等;3)臭氧消毒,用以代替氯對水進行消毒18.與化學藥劑處理法相比,臭氧法具有以下特點:能有效地控制有機微生物,使循環水中的COD和AOX的數量都被抑制在很低的水平,從而得到優良的水質;系統能在高濃縮倍數下運行,可實現零排污,節約水量,比化學藥劑法節約1/2-2/3;系統內不會產生結垢現象,同時,系統中原來形成的垢也能被有效去除;臭氧對系統具有良好的緩蝕作用;適應pH值范圍寬;運行費用大大低于化學藥劑。19.硫酸根自由基定義:硫酸根自由基(SO4-·)是具有較高氧化還原電位的自由基(E0=2.5v-3.1v),因此硫酸根自由基被認為在理想的條件下可以氧化絕大多數的有機物。通常是利用分解Oxone或過硫酸鹽的方式產生硫酸根自由基。20.硫酸根自由基的活化生成:加熱活化法;過渡金屬離子活化法;UV活化法;FeO活化法;活性炭活化法;納米Fe3O4活化法;氫氧化亞鐵溶膠活化;(單過硫酸氫鹽可經光、熱、催化等方式激發后,雙氧鍵斷裂,產生硫酸根自由基(SO4-?)。活化原理如式:SO52-+heat/UV/其他 → SO4-?+【O】)21.硫酸根與有機物的一般作用方式:奪氫作用、電子轉移作用、加成作用、(氧化作用)22.濕式氧化法:在高溫(150-350℃)和高壓(5-20MPa)下,用氧氣或空氣作為氧化劑,氧化水中溶解態或懸浮態的有機物或還原態的無機物,生成二氧化碳和水等小分子物質的技術。23.催化濕式氧化技術:在傳統的濕式氧化處理體系中加入催化劑降低反應的活化能,從而在不降低處理效果的情況下,降低反應溫度和壓力,用氧氣或空氣作為氧化劑,氧化水中溶解態或懸浮態的有機物或還原態的無機物,生成二氧化碳和水等小分子物質的技術.24.典型的濕法氧化工藝流程圖:
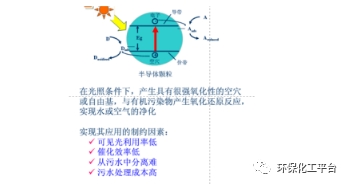
25.光催化的定義:就是光催化劑在光的作用下發生催化作用概括說來。半導體材料在光的照射下,將光能轉化為化學能,并促進有機物的分解,這一過程稱為光催化。
◎光催化劑:一種在光的照射下,自身不起變化,卻可以促進化學反應的物質。利用光能轉換成為化學反應所需的能量,產生催化作用,使周圍的氧氣及水分子激發成極具氧化力的自由基或負離子。◎光催化劑在光照條件(可以是不同波長的光照)下所起到催化作用的化學反應,統稱為光催化反應。◎光催化一般是多種相態之間的催化反應。26. 為什么要求TiO2光催化對很多有機物有較強的吸附作用?答:TiO2光催化分解水中污染物的過程中,表面產生的OH?基團起著決定性的作用,因而參加反應的物質以吸附在表面上的為主。有機物在催化劑表面被氧化要經過擴散、吸附、表面反應以及脫附等步驟。27.光催化技術的技術特征:①低溫深度反應;②綠色能源;③氧化性強;④壽命長;⑤廣譜性。光觸媒(光催化)的作用:①抗菌性;②空氣凈化;③除臭;④防霉防藻;⑤防污自潔。28.TiO2光催化材料的特性:①合適的半導體禁帶寬度;②具有良好的抗光腐蝕性和化學穩定性;③廉價,原料來源豐富,成本低;④光催化活性高(吸收紫外光性能強;禁帶和導帶之間的能隙大,光生電子的還原性和空穴的氧化性強);⑤對很多有機污染物有較強的吸附作用。29.TiO2光催化劑的改良:(促成·OH的生成與提高電子-空穴對分離效率是提高光催化氧化反應速率和效率的重要途徑)。①TiO2表面貴金屬沉積;②金屬離子摻雜,金屬離子摻雜把金屬離子引入到TiO2的晶格缺陷位置,金屬離子是電子的良好接受體,可以捕獲電子,由于金屬離子對電子的爭奪,減少了TiO2中光生電子和空穴的復合幾率,而產生更多的·OH,提高光催化效率;③加入氧化劑,向體系中加入氧化劑,使得催化劑表面的電子被氧化劑捕獲,可以有效地抑制電子和空穴復合,提高光催化的效率;常用的氧化劑有O3,O2,H2O2,Fe3+等;④復合光催化劑;⑤添加光敏化劑,光敏化劑作用是將光活性化合物化學吸附或物理吸附于光催化劑表面,從而擴大激發波長范圍,增加光催化反應的效率。30.TiO2在實際應用中的缺陷:①光生載流子容易重新復合,導致光量子效率很低。②帶隙能較寬,只能被波長較短的紫外線激發,這些紫外線占太陽能射線的4%~5%,太陽能利用率較低31.
32.硫酸根自由基用在水處理中的優點:
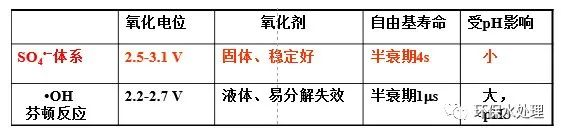
①具有極強的氧化性;②更易溶于水溶液中,便于產生的硫酸根自由基快速與水中的有機接觸并產生氧化作用,混溶性良好,使分解速率更高;③性質穩定,便于存放;④可適應的pH范圍較廣(pH=2-10),這增大可以處理廢水的范圍,不論酸性、堿性廢水,都對硫酸根自由基的反應活性影響不大;⑤不揮發或不產生氣體,不會導致濃度因為揮發降低硫酸根自由基的產量;⑥在水溶液中存在更長時間,一般情況存活時間可達到約4s左右的半衰期,較長的持續時長為其更多的降解有機污染物贏得了時間。33.例題:TiO2在紫外光的作用下,可以降解活性染料X3B。實驗發現,當在溶液中加入少量的Fe3+后,X3B的降解速率大大增加。試解釋原因。
答:Fe3+奪取光生電子的能力要大于分子氧。Fe3+通過快速轉移光生電子,抑制了載流子的復合,增加了空穴濃度。因此,X3B的降解速率大大加快。
34.什么是高級氧化技術?環境光催化技術的共性?答:高級氧化技術是指以羥基自由基為主要氧化物種的氧化過程。常用的高級氧化技術有TiO2光催化、雜多酸光催化、Photo-fenton反應、Fe3+光解和酞菁光敏化等。這些光催化技術的共性是產生具有強氧化能力的活性氧物種,如空穴(h+)、羥基自由基(?OH)、單線態氧(O21)和超氧自由基(O2?-)等。在這些活性物種的作用下,有機污染物不停地發生氧化降解,直至徹底礦化。35.Photo-fenton反應降解有機污染物的原理?
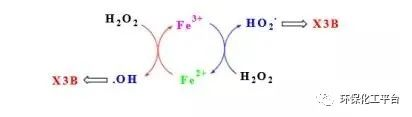
Fenton反應原理:
Fe2+離子能促進H2O2的分解,產生羥基自由基,自身被氧化為Fe3+。Fe3+也可以被H2O2還原,實現自身的循環,而H2O2被氧化為超氧自由基。羥基自由基和超氧自由基具有很強的氧化能力,使水中的有機污染物發生降解和礦化。在光的作用下,Fenton反應的速率大大加快。因而,有光參與的Fenton反應,又被稱為Photo-fenton反應。36.貴金屬表面沉積對TiO2光活性有什么影響?答:貴金屬通過改變電子的分布而修飾了半導體的性質。當兩種物質接觸時,電子就會不斷地從TiO2向沉積金屬遷移。貴金屬負載,可以電子和空穴分別定域在貴金屬和半導體上。抑制復合,高光催化活性。37.半導體TiO2受光激發后,電子和空穴的命運有哪幾種 ?答:(a)受光激發,電子-空穴對分離;(b)空穴擴散到催化劑表面,氧化有機物;(c)電子擴散到催化劑表面,還原分子氧;(d)電子-空穴的表面復合;(e)電子-空穴的體相復合38.簡述TiO2溶液中,可見光照射下的染料自敏化降解的原理答:在可見光的照射下,TiO2通常不能被激發,但染料分子可以被激發。(1)激發態的分子可以向二氧化鈦導帶注入電子,該電子被吸附在TiO2表面的分子氧俘獲,生存超氧負離子自由基。(2)超氧負離子自由基可以氧化染料陽離子,使它發生氧化降解。超氧負離子自由基也可以逐漸轉化為羥基自由基,再去氧化染料分子而發生降解。39.非金屬(如氮)摻雜TiO2有什么意義?其原理?摻雜TiO2方法的缺陷?
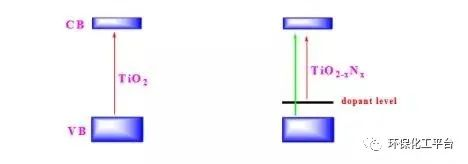
答:非金屬摻雜通過在TiO2的禁帶中間引入摻雜能級,效縮小TiO2的禁帶寬度,使TiO2的激發波長從紫外區拓展到可見光區,提高了可見光的催化活性。
缺點:①催化劑的穩定性下降;②空穴的氧化能力減弱;③可能犧牲催化劑的紫外光催化活性。(來源:環保水處理)